バイオナノマシン・キネシンの運動性基本原理を実証
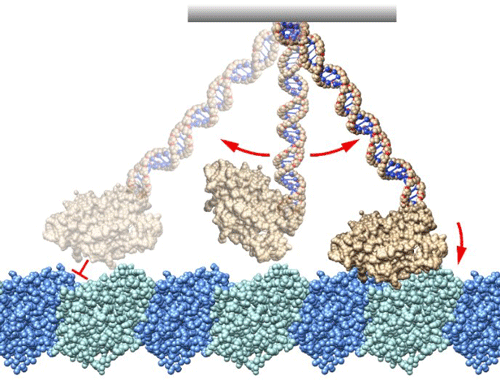
東京大学大学院総合文化研究科広域科学専攻の住吉里英子大学院生、山岸雅彦助教、矢島潤一郎教授、学習院大学の西坂崇之教授、国立研究開発法人情報通信研究機構(NICT)未来 ICT 研究所の古田茜研究員、古田健也研究マネージャーらは、バイオナノマシンの一種、キネシンのモータードメインを構成するループ領域に微小な DNAオリゴマーを結合させ、自在に運動支点をデザインする方法を開発し、どのような運動支点であってもキネシンは、細胞骨格・微小管に作用して一方向に力を発生できることを明らかにした。
従来は、モータードメインとテイルドメインを繋ぐリンカードメインの構造変化が力発生の起源と考えられていたが、本研究により従来モデルを大きく修正する必要が生じた。バイオナノマシンは、人間が作るマシンとどことなく似ているように捉えることもできるが、運動する仕組みは似て非なるものであり、本研究成果は、生体高分子から構成されるミクロなバイオナノロボットを設計するための指針を与えるものとして期待できるという。
我々の体を構成する細胞の中では、所狭しと 10 ナノメートル程の大きさのタンパク質からなるバイオナノマシンが働いている。染色体分配、細胞質分裂、細胞内小胞輸送等において力仕事を担うバイオナノマシン・キネシンやダイニンは、細胞骨格の一種である微小管上を運動することがよく知られている。キネシンの運動モデルとして、「ネックリンカードッキングモデル」が世界で流布している。このモデルでは、ネックリンカーと呼ばれるモータードメインの末端の 15 アミノ酸程度の領域が大きく構造を変え、このネックリンカーの構造変化が運動発生の実体であり、ちょうど人間が足首を曲げることで前方に移動することと類似するため直観的にわかりやすい運動モデルだった。しかし、これまでの先行研究では、ネックリンカーが運動に直接関わらない条件下でキネシンの運動を計測した報告はなく、ネックリンカーの構造変化とキネシンの運動の関係性は明確ではなかった。
(全文は7月29日付紙面に掲載)
この記事を書いた記者
- 主に行政と情報、通信関連の記事を担当しています。B級ホラーマニア。甘い物と辛い物が好き。あと酸っぱい物と塩辛い物も好きです。たまに苦い物も好みます。
最新の投稿
 情報通信2025.12.19先駆け―未来への方程式― アフリカで通信インフラを展開する「Dots for」
情報通信2025.12.19先駆け―未来への方程式― アフリカで通信インフラを展開する「Dots for」 情報通信2025.12.19電子版電波法令集の提供を開始 情報通信振興会
情報通信2025.12.19電子版電波法令集の提供を開始 情報通信振興会 行政2025.12.19総務省がR7年度版周波数再編アクションプラン策定
行政2025.12.19総務省がR7年度版周波数再編アクションプラン策定 筆心2025.12.192025年12月19日(7886号)
筆心2025.12.192025年12月19日(7886号)


